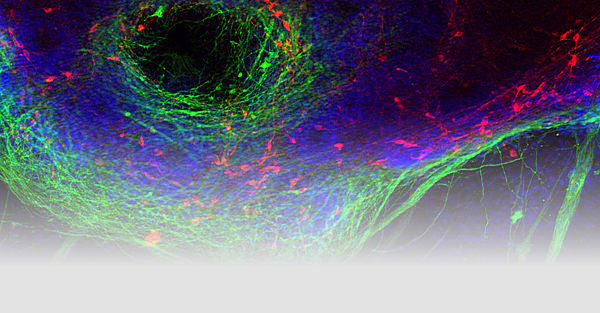
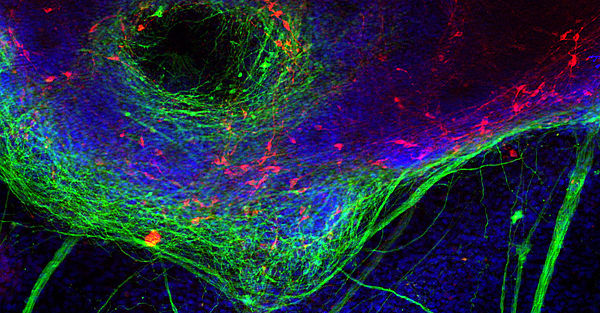
Altersbedingte neurodegenerative Erkrankungen sind eine schwere und zunehmend beunruhigende Belastung für unsere alternde Bevölkerung. Die meisten der chronischen neurodegenerativen Erkrankungen (Parkinson-Krankheit [PD], Lewy-Körper-Demenz [LBD], Alzheimer-Krankheit, frontotemporale Demenz [FTD], amyotrophe Lateralsklerose [ALS] usw.) sind durch intrazelluläre Proteineinschlüsse charakterisiert, die für jede dieser Krankheiten spezifisch sind. Wir untersuchen die strukturellen, molekularen, zellulären und histopathologischen Mechanismen, die der Aggregation des PD / DLB-assoziierten synaptischen Proteins α-Synuclein sowie der FTD / ALS-assoziierten Nukleinsäure-bindenden Proteine TDP-43 und FUS / TLS zugrunde liegen. Pathologische Wege werden in Zellkultur und Tiermodellen (Mäuse und Fliegen) modelliert. Die untersuchten Mechanismen umfassen Proteinaggregation und Phosphorylierung, Neuroinflammation, Mitophagie und nuklearen Import. Wir wollen die molekulare Basis der bemerkenswerten Spezifität der intrazellulären Proteinaggregation verstehen, die bestimmte neuronale Subpopulationen abtötet, die die charakteristischen Syndrome neurodegenerativer Bewegungsstörungen und Demenzen verursachen.
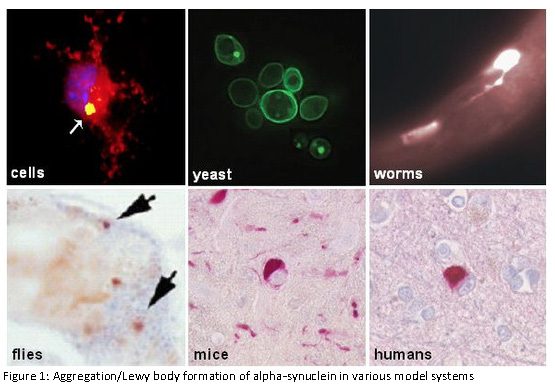
Die Forschungsgruppe wird gefördert vom Hertie-Institut und dem Deutschen Zentrum für Neurodegenerative Erkrankungen.
Characterisierung und Auswirkungen von α-Synukleinopathie in transgenen Mäusen
α-Synuklein gehört zu den wichtigsten genetischen Risikofaktoren für die Parkinson'sche Erkrankung und das Protein ist Hauptbestandteil von Lewy-Körperchen, den charakteristischen "Amyloid"-Ablagerungen in Gehirn von Parkinson-Patienten. Wir verwenden transgene Mäuse, welche unter der Kontrolle des ZNS-Neuron-spezifischen Promoters Thy1 eine human-pathogene Mutante (A30P) von α-Synuklein exprimieren. Diese Tiere zeigen im Verlaufe des Alterns α-Synukleinopathie, die der von menschlichen Patienten sehr ähnlich sieht. Die transgenen Mäuse zeigen schon früh kognitive Beeinträchtigungen, in Einklang mit Veränderungen neuronaler Aktivität in der Amygdala (Schell et al. 2012). In hohem Alter erleiden diese Mäuse schwerste lokomotorische Störungen, aufgrund von amyloiden Ablagerungen im Hirnstamm und Rückenmark. Das Erreichen des phänotypische Endstadiums wird zu jüngerem Alter verschoben, wenn die Tiere durch Hochfett-Diät prädiabetisch gemacht werden (Rotermund et al. 2014). Wir erforschen nun weiter in Zellkultur und in vivo epigenetische Mechanismen, die von α-Synuklein beeinflusst werden (Sugeno et al. 2016). Diese Arbeiten werden unterstützt vom Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) und dem transnationalen Deutsch-Kanadisch-Französischen Epigenomik-Consortium DecipherPD.
Regulation von LRRK2 in Makrophagen
LRRK2-Mutationen sind die häufigste Ursache von autosomal-dominant vererbtem Morbus Parkinson sowie ein gravierender genetischer Risikofaktor auch für die sporadischen Formen. Trotz intensiver Forschung ist kaum verstanden, welche zellulären Funktionen LRRK2 wie genau ausübt. Interessanterweise befinden sich die Zellen mit höchster LRRK2-Expression im Immunsystem. Wir konnten den Signalweg aufklären, über den Interferon- LRRK2 in Makrophagen induziert. Die Extrazellulärsignal-regulierte Kinase ERK5 ist hierbei essentiell (Kuss et al. 2014). Wir versuchen die Rolle von LRRK2 in stimulierten Makrophagen weiter aufzuklären.
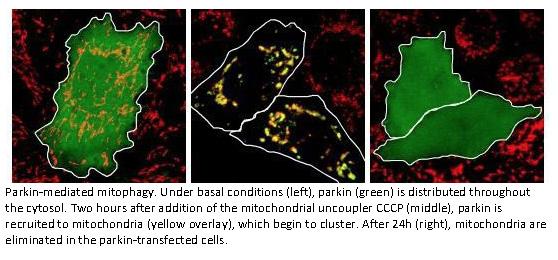
Regulation und Mechanismen von PINK1/Parkin-vermittelter Mitophagie
Die meisten autosomal-rezessiv vererbten Fälle der Parkinson-Krankheit sind verursacht durch Mutationen in den Genen PINK1 und PARKIN. PINK1 ist eine mitochondriale Proteinkinase, und das Parkin-Enzym ist eine E3-Ubiquitinligase. PINK1 und Parkin regulieren die autophagische Elimination geschädigter Mitochondrien, was durch Parkinson-Mutationen beeinträchtigt wird (Geisler et al. 2010a,b). Während dieser sog. Mitophagie ubiquitinyliert Parkin eine Reihe von Substraten, wodurch abzubauende Mitochondrien für Autophagie gekennzeichnet werden. Wir konnten wesentliche E2 Ubiquitin-konjugierende Enzyme als Parkin-Cofaktoren für Mitophagie identifizieren (Geisler et al. 2014). Die komplexen Ubiquitinylierungsprozesse bei der Mitophagie sind Gegenstand gegenwärtiger Forschung.
Zellbiologie von TDP-43 und FUS
Ablagerungen der Nukleinsäure-bindenden Proteine TDP-43 und FUS/TLS sind neuropathologische Merkmale von Patienten mit frontotemporaler Demenz und amyotropher Lateralsklerose. Die pathogene Wirkung auch von Mutationen in diesen Genprodukten bleibt aufzuklären. Zur Identifikation von TDP-43 regulierten mRNAs haben wir transkriptomische Studien durchgeführt, und fanden dabei die Deacetylase HDAC6 und die Exon-Junction-Komplex-Komponente SKAR, welche auch funktionell validiert wurden (Fiesel et al. 2010, 2011, 2012). Wir konnten UBE3E Ubiquitin-konjugierende Enzyme und die Ubiquitin-Isopeptidase UBPY als Enzyme identifizieren, die eine ungewöhnliche Art der Ubiquitinylierung von TDP-43 regulieren, welche zur Protein-Unlöslichkeit und Neurodegeneration im Fliegenmodell führt (Hans et al. 2014). Die post-translationalen Modifikationen (Ubiquitinylierungen und Acetylierungen) von TDP-43 werden systematisch intensiver untersucht. Für FUS konnten wir in Drosophila die Bedeutung von Kernimport und Arginin-Methyltransferase 1 bestätigen (Jäckel et al. 2015). Diese Arbeit wird unterstützt von der Deutschen Forschungsgemeinschaft (DFG), dem Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) und der NOMIS-Stiftung.
Ausgewählte aktuelle Originalartikel
Jäckel, S., Summerer, A. K., Thömmes, C. M., Pan, X., Voigt, A., Schulz, J. B., Rasse, T. M., Dormann, D., Haass, C., and Kahle, P. J. (2015) Nuclear import factor transportin amd arginine methyltransferase 1 modify FUS neurotoxicity in Drosophila. Neurobiol. Dis. 74, 76-88
Rotermund, C., Truckenmüller, F. M., Schell, H., and Kahle, P. J. (2014) Diet-induced obesity accelerates the onset of terminal phenotypes in a-synuclein transgenic mice. J. Neurochem. 131, 848-858
Geisler, S., Vollmer, S., Golombek, S., and Kahle, P. J. (2014) UBE2N, UBE2L3 and UBE2D2/3 ubiquitin-conjugating enzymes are essential for parkin-dependent mitophagy. J. Cell Sci. 127, 3280-3293
Hans, F., Fiesel, F. C., Strong, J. C., Jäckel, S., Rasse, T. M., Geisler, S., Springer, W., Schulz, J. B., Voigt, A., and Kahle, P. J. (2014) UBE2E ubiquitin-conjugating enzymes and ubiquitin isopeptidase Y regulate TDP-43 protein ubiquitination. J. Biol. Chem. 289, 19164-19179
Kuss, M., Adamopoulou, E., and Kahle, P. J. (2014) Interferon-gamma induces leucine-rich repeat kinase LRRK2 via extracellular signal-regulated kinase ERK5 in macrophages. J. Neurochem. 129, 980-987
Schell, H., Boden, C., Maia Chagas, A., and Kahle, P. J. (2012) Impaired c-Fos and polo-like kinase 2 induction in the limbic system of fear-conditioned alpha-synuclein transgenic mice. PLoS ONE 7, e50245
Fiesel, F. C., Weber, S. S., Supper, J., Zell, A., and Kahle, P. J. (2011) TDP-43 regulates global translational yield by splicing of exon junction complex component SKAR. Nucleic Acids Res. 40, 2668-2682
Geisler, S., Holmström, K. M., Treis, A., Skujat, D., Weber, S. S., Fiesel, F. C., Kahle, P. J., and Springer, W. (2010) The PINK1/parkin-mediated mitophagy is compromised by PD-associated mutations. Autophagy 6, 871-878
Geisler, S., Holmström, K. M., Skujat, D., Fiesel, F. C., Rothfuss, O. C., Kahle, P. J., and Springer, W. (2010). PINK1/Parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1. Nat. Cell Biol. 12, 119-131
Fiesel, F. C., Voigt, A., Weber, S. S., Van den Heute, C., Waldenmaier, A., Görner, K., Walter, M., Anderson, M. L., Kern, J. V., Rasse, T. M., Schmidt, T., Springer, W., Kirchner, R., Bonin, M., Neumann, M., Baekelandt, V., Alunni-Fabbroni, M., Schulz, J. B., and Kahle, P. J. (2010) Knockdown of transactive response DNA-binding protein (TDP-43) downregulates histone deacetylase 6. EMBO J. 29, 209-221

Hertie-Zentrum für Neurologie
Hertie-Institut für klinische Hirnforschung
Abteilung Neurologie mit Schwerpunkt neurodegenerative Erkrankungen
Otfried-Müller-Straße 27
72076 Tübingen
Tel.: +49 (0)7071 29-81970
Fax: +49 (0)7071 29-4620









