Personalisierte neurorehabilitative Präzisionsmedizin: Von Daten zu Therapien (Akronym: MWKNeuroReha)
Klicken Sie auf das Bild, um es zu vergrößern
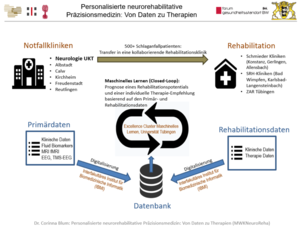
Schlaganfälle sind die häufigste Ursache bleibender Behinderung. Die vorliegende Studie untersucht, welche Faktoren am besten vorhersagen, in wie weit Schlaganfallpatienten von der Neurorehabilitation profitieren und welche Rehabilitationsmaßnahmen am besten helfen. Dazu werden klinische, elektrophysiologische, bildgebende und Labordaten in der akuten Phase des Schlaganfalls sowie später während der Rehabilitation und nach 90 Tagen gesammelt.
Für jeden Patienten mit akutem Schlaganfall, der die oberen Extremitäten betrifft, werden Daten gesammelt, um die Beeinträchtigung und den Schweregrad des Schlaganfalls zu bestimmen. Diese bestehen aus klinischen Tests, struktureller und funktioneller Magnetresonanztomographie, motorisch evozierten Potenzialen, Elektroenzephalographie und Laboruntersuchungen. Bei der Aufnahme in eine der kooperierenden Rehakliniken und in Abständen von 14 Tagen werden Beeinträchtigungen und Behinderungen dort erneut getestet und dem Datensatz jedes Patienten hinzugefügt, um Funktionserholung nach Schlaganfall im Verlauf zu quantifizieren. Darüber hinaus werden während der stationären Zeit in den Neurorehabilitationskrankenhäusern Menge und Art der neurorehabilitativen Behandlungen dokumentiert. 90 Tage nach dem Schlaganfall wird die Beeinträchtigung der oberen Extremität erneut gemessen (primärer Endpunkt). Außerdem werden die Mobilität der oberen Extremität, die Beeinträchtigung im täglichen Leben und die Lebensqualität bewertet (sekundäre Endpunkte).
Nach einem Closed-Loop-Ansatz werden die Daten dann von einem Algorithmus für maschinelles Lernen analysiert, um eine personalisierte Rehabilitationsstrategie zu erstellen.
Diese Studie wird vom „Forum Gesundheitsstandort Baden-Württemberg“ des Ministeriums für Wissenschaft, Forschung und Kunst Baden-Württemberg finanziert.
Link: Study protocol MWKNeuroReha
Email:NeuroRehamed.uni-tuebingen.de
ConnectToBrain
ConnectToBrain wird die transkranielle Ganzhirn-Multi-Lokus-Magnetstimulation (mTMS) einführen, bei der die Position, Richtung, Stärke und das Timing des hirnstimulierenden elektrischen Feldes elektronisch auf der Grundlage von Echtzeit-High-Density-Elektroenzephalographie-(hdEEG)-Aktivitätsinformationen gesteuert werden und Konnektivität in Gehirnnetzwerken.
Überlagerungen von elektrischen Feldern, die von den verschiedenen überlappenden Spulen erzeugt werden, ermöglichen raumzeitliche millimeter- und millisekundengenaue Reizsequenzen zu beliebigen kortikalen Stellen ohne physische Bewegungen des Spulensatzes. Das räumliche Targeting von mTMS wird durch die Messung der individuellen Gehirnleitfähigkeitsverteilungen mit Ultra-Low-Field-MRT weiter verbessert.
ConnectToBrain wird eine beispiellose Verfolgung dynamischer Veränderungen und die Reorganisation von Gehirnnetzwerken in Echtzeit sowie eine netzwerkorientierte Closed-Loop-Stimulation ermöglichen. Diese radikal neuartige Technologie wird einen Paradigmenwechsel gegenüber der derzeitigen Open-Loop-Praxis bewirken, die in der Therapie nur mäßig wirksam ist. Wir werden ConnectToBrain anwenden, um ein neues Maß an Wirksamkeit therapeutischer Anwendungen zu erreichen. Patienten nach Schlaganfall und Alzheimer werden getestet und als Modelle für Netzwerkstörungen behandelt.
Unser risikoreiches und gewinnbringendes Unterfangen wird die ehrgeizigen Ziele nur durch die Synergie von 3 Principal Investigators erreichen, die in ihren komplementären Fachgebieten (Instrumentierung, Algorithmen, Übersetzung) weltweit führend sind: Prof. Risto Ilmoniemi, Prof. Gian Luca Romani, und Prof. Ulf Ziemann. Wenn ConnectToBrain erfolgreich ist, erwarten wir, dass der Wert des gesellschaftlichen, gesundheitlichen und industriellen Nutzens in Europa jährlich 1 Milliarde Euro übersteigen wird, ganz zu schweigen von dem immensen Wert der Linderung des menschlichen Leidens an Gehirnerkrankungen
Weitere Informationen zur ConnectToBrain-Initiative finden Sie unter: https://www.connecttobrain.eu/
Pharmakologische Modulation von TMS-evozierten EEG Antworten
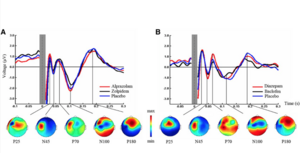
Die Möglichkeit, mittels transkranieller Magnetstimulation (TMS) Hirnfunktionen bei gesunden Probanden und Patienten mit Hirnschädigungen zu verstehen, kann durch die Kombination mit anderen elektrophysiologischen und bildgebenden Methoden oder durch die Kombination von TMS mit einer pharmakologischen Exposition deutlich verbessert werden. Insbesondere die zeitgleiche Aufzeichnung von Hirnströmen mittels EEG erlaubt es, die Effekte von TMS auf das Gehirn mit guter räumlicher und exzellenter zeitlicher Auflösung direkt zu untersuchen.
TMS-evozierte Potentiale (TEP) nach einer Einzelpuls-TMS des primären Motorkortex können sowohl an der Stimulationsstelle als auch in entfernten Gehirnregionen für bis zu 300ms nach dem Stimulus aufgezeichnet werden. Die zugrunde liegenden physiologischen Mechanismen der TEP sind jedoch nicht gut verstanden.
In diesem Projekt sollen die physiologischen Mechanismen von TMS-evozierten EEG Ableitungen durch eine pharmakologische Modulation von GABAerger Neurotransmission näher charakterisiert werden.
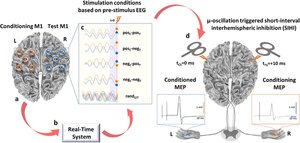
Modulation des kortikalen Motornetzwerkes durch
Mehrspulen-TMS
Die koordinierte neuronale Aktivität in weit verzweigten Netzwerken des Gehirns ist die Basis für höhere kognitive Funktionen und komplexe sensomotorische Fähigkeiten. Im motorischen Funktionssystem bilden zahlreiche Hirnareale wie der dorsale prämotorische Kortex, der ventrale prämotorische Kortex, das supplementärmotorische Areal, der Parietalkortex, die Basalganglien und das Kleinhirn zusammen mit dem primären Motorkortex ein motorisches Netzwerk.
Neuronale Koordination ist hochgradig dynamisch und hängt sowohl von der motorischen Aufgabe als auch vom Zustand des Gehirns ab. Zudem ist die effektive Konnektivität im motorischen Netzwerk des Gehirns nach einer Hirnschädigung (z.B. durch einen Schlaganfall) stark verändert. Entscheidend ist hierbei, dass Änderungen der Netzwerkarchitektur mit Veränderungen von motorischen Fähigkeiten korrelieren.
In diesem Projekt nutzen wir Mehrspulen-TMS, um effektive Konnektivitäten im kortikalen Motornetzwerk gezielt zu modifizieren und untersuchen die Effekte auf motorische Fähigkeiten und Lernen.
Reorganisation von zerebralen Netzwerken bei Multipler Sklerose
Bei der Multiplen Sklerose (MS) kommt es zum Auftreten von multiplen entzündlichen ZNS-Läsionen, wodurch zerebrale Netzwerke signifikant gestört werden können. Im Gegensatz zu einer akut auftretenden Hirnschädigung wie bei einem Schlaganfall entwickeln sich diese Läsionen über die Zeit hinweg, so dass dem Gehirn mehr Zeit bleibt, sich zu reorganisieren und zu kompensieren. Dennoch zeigen sich klinisch bereits in einem frühen Erkrankungsstadium häufig Einschränkungen in kognitiven Funktionen wie Aufmerksamkeit und Gedächtnis.
Im Rahmen dieses Projektes sollen Veränderungen zerebraler Netzwerke bei Patienten mit MS mittels fMRT und MEG dargestellt und deren Einfluss auf kognitive Funktionen untersucht werden. Diese Untersuchungen erlauben potentiell auch eine neurobiologische Charakterisierung der Wirkung von immunmodulierenden Medikamenten sowie die Identifizierung von Biomarkern zur Therapieüberwachung.
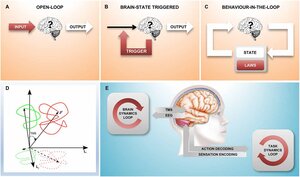
Closed-Loop-Stimulation
Wir untersuchen die Zusammenhänge zwischen dem augenblicklichen Zustand kognitiver Prozesse und der kortikalen Informationsverarbeitung. Ein gleichzeitiger EEG-TMS Aufbau mit echtzeit Signalanalyse ermöglicht eine EEG-gesteuerte Auslösung der Stimulus-Pulse mit deterministischen Latenzen von unter 3 Millisekunden. Unsere initialen Experimente untersuchen den Einfluss der Phase von kortikaler EEG-Alpha Aktivität während der TMS-Pulse auf die kortikospinale Erregbarkeit und Plastizität. Im Rahmen eines Translationsforschungsprojektes entwickeln wir basierend auf diesen Ansatz neue und effektivere, therapeutische EEG-gesteuerte TMS-Protokolle für die Neurorehabilitation.

Lokale Kooperationspartner
Prof. Christoph Braun
MEG-Zentrum, Universitätsklinikum Tübingen
Prof. Alireza Gharabaghi, Dr. Paolo Belardinelli
Klinik für Neurochirurgie, Universitätsklinikum Tübingen
Prof. Klaus Scheffler
Max-Planck-Institut für biologische Kybernetik
Prof. Cornelius Schwarz
Center for Integrative Neuroscience (CIN)
Prof. Markus Siegel
MEG-Zentrum, Universitätsklinikum Tübingen
Nationale Kooperationspartner
Dipl. Psych. Daniel Scholz, Prof. Eckart Altenmüller
Institut für Musikphysiologie und Musikermedizin, Hochschule für Musik, Theater und Medien, Hannover
Dr. Andreas Vlachos, Dr. Peter Jedlicka, Prof. Thomas Deller
Institut für Klinische Neuroanatomie, Goethe-Universität Frankfurt
Internationale Kooperationspartner
Prof. Vincenzo di Lazzaro
Institute of Neurology, Campus BioMedico University, Rom, Italien
Prof. John Rothwell
Sobell Department of Motor Neuroscience and Movement Disorders, UCL Institute of Neurology, Queen Square, London WC1N 3BG, United Kingdom
Prof. Hartwig Siebner, Prof. Axel Thielscher
Danish Research Centre for Magnetic Resonance, Center for Functional and Diagnostic Imaging and Research, Copenhagen University Hospital Hvidovre, Hvidovre, Dänemark
Dr. Cathy Stinear, Prof. Winston Byblow
Department of Sport and Exercise Science and Centre for Brain Research, University of Auckland, Neuseeland
Gesamtübersicht der Publikationen
Ausgewählte Originalarbeiten
Gordon, P., Belardinelli, P., Stenroos, M., Ziemann, U., & Zrenner, C. (2022). Prefrontal theta phase-dependent rTMS-induced plasticity of cortical and behavioral responses in human cortex. Brain Stimulation, 15(2), 391-402. https://doi.org/10.1016/j.brs.2022.02.006
Metsomaa, J., Belardinelli, P., Ermolova, M., Ziemann, U., & Zrenner, C. (2021). Causal decoding of individual cortical excitability states. Neuroimage, 245, 118652. https://doi.org/10.1016/j.neuroimage.2021.118652
Humaidan, D., Vetter, D., Metsomaa, J., Ermolova, M., & Ziemann, U. (2021). Reinforcement machine learning for closed-loop rTMS stimulation of brain networks. Brain Stimulation, 14(6), 1696. https://doi.org/10.1016/j.brs.2021.10.346
Baur, D., Galevska, D., Hussain, S., Cohen, L., Ziemann, U., & Zrenner, C. (2020). Induction of LTD-like corticospinal plasticity by low-frequency rTMS depends on pre-stimulus phase of sensorimotor μ-rhythm. Brain Stimulation, 13(6), 1580-1587. https://doi.org/10.1016/j.brs.2020.09.005
Stefanou, M., Galevska, D., Zrenner, C., Ziemann, U., & Nieminen, J. (2020). Interhemispheric symmetry of µ-rhythm phase-dependency of corticospinal excitability. Scientific Reports, 10(1). https://doi.org/10.1038/s41598-020-64390-w
Zrenner, B., Zrenner, C., Gordon, P., Belardinelli, P., McDermott, E., & Soekadar, S. et al. (2020). Brain oscillation-synchronized stimulation of the left dorsolateral prefrontal cortex in depression using real-time EEG-triggered TMS. Brain Stimulation, 13(1), 197-205. https://doi.org/10.1016/j.brs.2019.10.007
Stefanou, M., Baur, D., Belardinelli, P., Bergmann, T., Blum, C., Gordon, P., Nieminen, J., Zrenner, B., Ziemann, U. and Zrenner, C., 2019. Brain State-dependent Brain Stimulation with Real-time Electroencephalography-Triggered Transcranial Magnetic Stimulation. Journal of Visualized Experiments, (150). doi:10.3791/59711
Baur, D., Hussain, S., Cohen, L., Ziemann, U. and Zrenner, C., (2019). The influence of ongoing μ-oscillation phase on the induction of LTD-like plasticity with 1 Hz rTMS. Brain Stimulation, 12(2), p.565. DOI:https://doi.org/10.1016/j.brs.2018.12.872
Zrenner, B., Gordon, P., Kempf, A., Belardinelli, P., McDermott, E., Soekadar, S., Fallgatter, A., Zrenner, C., Ziemann, U. and Dahlhaus, F., (2019). Alpha-synchronized stimulation of the left DLPFC in depression using real-time EEG-triggered TMS. Brain Stimulation, 12(2), p.532.https://doi.org/10.1016/j.brs.2019.10.007
Zrenner, C., Desideri, D., Belardinelli, P., & Ziemann, U. (2018). Real-time EEG-defined excitability states determine efficacy of TMS-induced plasticity in human motor cortex. Brain Stimulation, 11(2), 374-389. https://doi.org/10.1016/j.brs.2017.11.016

Hertie-Zentrum für Neurologie
Hertie-Institut für klinische Hirnforschung
Abteilung Neurologie mit Schwerpunkt neurovaskuläre Erkrankungen
Hoppe-Seyler-Str. 3
72076 Tübingen
Christine Riegraf
Tel.: +49 (0)7071 29-82049
Fax: +49 (0)7071 29-5260
christine.riegraf@med.uni-tuebingen.de